วันจันทร์ที่ 9 กันยายน พ.ศ. 2562
ข้อสอบ O-net พร้อมเฉลย
ข้อสอบ O-net พร้อมเฉลย
ข้อ 27 ตอบข้อ 2 เหตุผล ยางวัลคาไนซ์มีการเติมซัลเฟอร์เพื่อปรับปรุงคุณสมบัติ
ข้อ 1 SiO2 เป็นของแข็งไม่ใช่ก๊าซ ข้อ 4 NH3 ละลาบน้ำแล้วสมบัติเป็นเบส ส่วนข้อ 3 พอลิไวนิลอซิเตตไม่มี Cl ในโครงสร้างเมื่อเผาจึงไม่น่าจะสามารถสลายให้ HCl ได้ ข้อ 28 ตอบข้อ 3,4 ข้อ 1 เคี้ยวข้าว แป้งโดนย่อยเป็นมอลโทส ข้อ 2 สบู่จับกับไอออนบางชนิดที่มีในน้ำกระด้างกลายเป็นไคลสบู่
ข้อ 31 ตอบข้อ 1 เพราะ จะเผาไหม้ได้ก๊าซคาร์บอนไดออกไซด์และน้ำได้ต้องเป็นสารอินทรีย์ และเกิดการ เผาไหม้แบบเผาไหม้สมบูรณ์ปล. ข้อ 2 แก๊สโซฮอล์ คือ เอทานอล + น้ำมันเบนซิน ข้อ 4 แก๊สธรรมชาติ หมายถึง แก๊สมีเทน
ข้อ 32 ตอบข้อ 1 เพราะ อุณหภูมิต่ำลงเป็นปฏิกิริยาดูดความร้อน
ข้อ 33 ตอบข้อ 2 เพราะเกิดแก๊ส
ข้อ 1 สบู่ละลายได้ทั้งน้ำและไขมัน เพราะมีส่วนทั้งส่วนที่มีขั้วและไม่มีขั้ว ข้อ 3 โปรตีนเสียสภาพ กลับคืนไม่ได้ ข้อ 4 ไม่ใช่ตัวเร่ง แต่มันเกิดปฏิกิริยาเอง (ไฟฟ้าเคมี) แบบเซลล์ทุติยภูมิ
ข้อ 34 ตอบข้อ 1,3
ข้อ 35 ตอบข้อ 1 เพราะ การดูดความชื้นไม่ถือเป็นปฏิกิริยาเคมี
ข้อ 2 ก็ตอบได้ครับเพราะกระดาษที่ใช้งานไม่ได้คือกระดาษขาดไม่เกิดปฏิกิริยาเคมี ส่วนพลาสติก
เกิดปฏิกิริยเคมีเพราะ เกิดการขาดออกของสายโซ่ เป็นต้น
ข้อ 36 ตอบข้อ 3 H+ มีโปรตอน 1 นิวตรอน 0 อิเล็กตรอน 0
ข้อ 37 ตอบข้อ 1 ไอโซโทปคือ ธาตุที่มีจำนวนโปรตอนเท่ากัน ส่วนข้อ 3 คือธาตุเดียวกับที่โจทย์ให้ เพิ่มเติม ไอโซโทน คือ นิวตรอนเท่ากัน ไอโซบาร์ คือ เลขมวลเท่ากัน ไอโซอิเล็กทรอนิกส์คืออิเล็กตรอนเท่ากัน
ข้อ 38 ตอบข้อ 4 เมื่อจัดเรียงอิเล็กตรอนแล้วจะได้ดังนี้ A 2,2 B 2,8,3 C 2,8,7
ข้อ 39 ตอบข้อ 3 ก. เกลือแกง NaCl โซดาไฟ NaOH
ข้อ 40 ตอบข้อ 3 สมมติให้ตอนแรกมี 100 จะสลายตัวดังนี้
100--->50--->25--->12.5--->6.25 ครึ่งชีวิต 5000 ปี แสดงว่าทั้งหมดจะใช้เวลา 20,000 ปี
ข้อ 59 ตอบข้อ 2 อ้างอิงจากแบบเรียน สารและสมบัติของสารหน้า 117 เรื่องประโยชน์ของธาตุกัมมันตรังสี
ข้อ 69 ตอบข้อ 1 เพราะ มีโปรตอน 9 แสดงว่าเลขข้างล่าง คือ 9 นิวตรอน 10 แสดงว่า เลขบน-เลขล่าง คือ 10
ข้อ 70 ตอบข้อ 1 เมื่อจัดเรียงอิเล็กตรอนแล้วจะได้ 2 7 คือ หมู่ 7 คาบ 2 นั่นคือ F ซึ่งอยู่ในรูปของ
Diatomic molecule
ข้อ 71 ตอบข้อ 4 เพราะ ข้อ 1 2 ถูก ฟลูออรีนอยู่ในสถานะแก๊ส ไอออนมีประจุ -1
ซึ่งเมื่เกิดสารประกอบกับ Ca ซึ่งเป็นโลหะ หมู่ 2 จะมีสูตร CaX2
ข้อ 72 ตอบข้อ 2 เพราะอัตราไม่คงที่ ไม่ได้ลดลงตามเวลา ข้อ 73 ตอบข้อ 2 เพราะ แอมโมเนีย 2 โมล พอดีกับ คาร์บอนมอนออกไซด์ 1 โมล ถ้าใช้ แอมโมเนีย 3 โมล และคาร์บอนไดออกไซด์ 1 โมล จะเหลือแอมโมเนีย 1 โมล และมีน้ำเกิด ขึ้นอีก 1 โมล ข้อ74 ตอบข้อ ไม่เฉลยเพราะไม่เข้าใจโจทย์ หากอ้างอิงจากข้อ 73 จะตอบข้อ 2 เพราะ แอมโมเนียเป็นตัวเหลือพ่นลงน้ำรวมกับไอน้ำที่เกิดขึ้น
3.5 การใช้ประโชน์ของสารประกอบไอออนิก สารโคเวเลนต์ และโลหะ
3.5 การใช้ประโชน์ของสารประกอบไอออนิก สารโคเวเลนต์ และโลหะ
สมบัติบางประการของสารประกอบไอออนิก สารโคเวเลนต์ และโลหะ
จากการที่สารประกอบ
ไอออนิกสารโคเวเลนต์และ
โลหะมีสมบัติเฉพาะตัวมา
ว่าการที่ต่างกันจึงสามารถนำ
มาใช้ประโยชน์ในด้านต่างๆ
ได้ตามความเหมาะสม เช่น
-แอมโมเนียมคลอไรด์และซิงค์คลอไรด์
เป็นสารประกอบไอออนิกที่สามารถนำไฟฟ้า
ได้จากการแตกตัวเป็นไอออนเมื่อละลายน้ำจึงนำไปใช้เป็นสารอิเล็กโทรไลต์ในถ่านไฟฉาย
-พอลิไวนิลคลอไรด์หรือ PVC เป็นสารโคเวเลนต์ที่ไม่สามารถนำไฟฟ้า
ได้จึงเป็นฉนวนไฟฟ้าที่หุ้มสายไฟฟ้า -ซิลิกอนคาร์ไบด์ เป็นสารโคเวเลนต์โครงร่า
ตาข่ายที่มีจุดหลอมเหลวสูงและมีความแข็งแรงมากจึงนำไปใช้ทำเครื่องบด
-ทองแดงและอะลูมิเนียม เป็นโลหะที่นําไฟฟ้าได้ดีจึงนำไปใช้เป็นตัวนำไฟฟ้าอลูมิเนียม
และเหล็กเป็นโลหะที่นําความร้อนได้ดีจึงนำไปทำภาชนะสำหรับประกอบอาหาร เช่น หม้อ กะทะ
3.4 พันธะโลหะ
3.4 พันธะโลหะ
พันธะโลหะ (Metallic bonding) เป็นพันธะภายในโลหะซึ่งเกี่ยวข้องกับ
การเคลื่อนย้าย อิเล็กตรอน อิสระระหว่างแลตทิซของอะตอม
โลหะดังนั้นพันธะโลหะจึงอาจเปรียบได้กับเกลือที่หลอมเหลว
อะตอมของโลหะมีอิเล็กตรอนพิเศษเฉพาะในวงโคจรชั้นนอก
ของมันเทียบกับคาบ(period)หรือระดับพลังงานของพวกมัน
อิเล็กตรอนที่เคลื่อนย้ายเหล่านี้ เปรียบได้กับทะเลอิเล็กตรอน
(Sea of Electrons) ล้อมรอบแลตทิชขนาดใหญ่ของ
ไอออนบวกพันธะโลหะเทียบได้กับพันธะโควาเลนต์ที่เป็น
นอน-โพลาร์ ที่จะไม่มีในธาตุโลหะบริสุทธ์ หรือมีน้อยมากใน
โลหะผสม ความแตกต่าง อิเล็กโตรเนกาทิวิตีระหว่างอะตอม
ซึ่งมีส่วนในปฏิกิริยาพันธะ และอิเล็กตรอนที่เกี่ยวข้อง
ในปฏิกิริยาจะเคลื่อนย้ายข้ามระหว่างโครงสร้างผลึกของโลหะ
พันธะโลหะเขียนสูตรทางเคมีไม่ได้ เพราะไม่ทราบจำนวนอะตอมที่แท้จริง

อาจจะมีเป็นล้านๆ อะตอมก็ได้
การเคลื่อนย้าย อิเล็กตรอน อิสระระหว่างแลตทิซของอะตอม
โลหะดังนั้นพันธะโลหะจึงอาจเปรียบได้กับเกลือที่หลอมเหลว
อะตอมของโลหะมีอิเล็กตรอนพิเศษเฉพาะในวงโคจรชั้นนอก
ของมันเทียบกับคาบ(period)หรือระดับพลังงานของพวกมัน
อิเล็กตรอนที่เคลื่อนย้ายเหล่านี้ เปรียบได้กับทะเลอิเล็กตรอน
(Sea of Electrons) ล้อมรอบแลตทิชขนาดใหญ่ของ
ไอออนบวกพันธะโลหะเทียบได้กับพันธะโควาเลนต์ที่เป็น
นอน-โพลาร์ ที่จะไม่มีในธาตุโลหะบริสุทธ์ หรือมีน้อยมากใน
โลหะผสม ความแตกต่าง อิเล็กโตรเนกาทิวิตีระหว่างอะตอม
ซึ่งมีส่วนในปฏิกิริยาพันธะ และอิเล็กตรอนที่เกี่ยวข้อง
ในปฏิกิริยาจะเคลื่อนย้ายข้ามระหว่างโครงสร้างผลึกของโลหะ
พันธะโลหะเขียนสูตรทางเคมีไม่ได้ เพราะไม่ทราบจำนวนอะตอมที่แท้จริง

อาจจะมีเป็นล้านๆ อะตอมก็ได้
แบบจำลองทะเลอิเล็กตรอน (Sea of electrons)
การเกิดพันธะในโลหะนี้ ทำให้โลหะมีสมบัติต่างๆ ดังนี้
-นำไฟฟ้าและความร้อนได้ดี
-มีจุดเดือดและจุดหลอมเหลวสูง
-มีลักษณะเป็นเงาและมีความวาวเมื่อถูกแสง
-สามารถดึงเป็นเส้น ตีเป็นแผ่น หรือบิดงอได้
3.3 พันธะโคเวเลนต์
3.3 พันธะโคเวเลนต์
พันธะโควาเลนต์ (Covalent bond) หมายถึง พันธะในสารประกอบที่เกิดขึ้นระหว่างอะตอม 2 อะตอมที่มีค่าอิเล็กโตรเนกาติวิตีใกล้เคียงกันหรือเท่ากัน แต่ละอะตอมต่างมีความสามารถที่จะดึงอิเล็กตรอนไว้กับตัว อิเล็กตรอนคู่ร่วมพันธะจึงไม่ได้อยู่ ณ อะตอมใดอะตอมหนึ่งแล้วเกิดเป็นประจุเหมือนพันธะไอออนิก หากแต่เหมือนการใช้อิเล็กตรอนร่วมกันระหว่างอะตอมคู่ร่วมพันธะนั้นๆและมีจำนวนอิเล็กตรอนอยู่รอบๆ แต่ละอะตอมเป็นไปตามกฎออกเตต ดังภาพ
เป็นพันธะที่เกิดจากการใช้อิเล็กตรอนข้างนอกร่วมกันระหว่างอะตอมของธาตุหนึ่งกับอีกธาตุหนึ่งแบ่งเป็น 3 ชนิดด้วยกัน
1. พันธะเดี่ยว (Single covalent bond )เกิดจากการใช้อิเล็กตรอนร่วมกัน 1 อิเล็กตรอน เช่น F2 Cl2 CH4 เป็นต้น
2. พันธะคู่ ( Doublecovalent bond ) เกิดจากการใช้อิเล็กตรอนร่วมกันของธาตุทั้งสองเป็นคู่ หรือ 2 อิเล็กตรอน เช่น O2 CO2 C2H4 เป็นต้น
3. พันธะสาม ( Triple covalent bond ) เกิดจากการใช้อิเล็กตรอนร่วมกัน 3 อิเล็กตรอน ของธาตุทั้งสอง เช่น N2 C2H2 เป็นต้น
การอ่านชื่อสารประกอบโควาเลนซ์
- สารประกอบของธาตุคู่ ให้อ่านชื่อธาตุที่อยู่ข้างหน้าก่อน แล้วตามด้วยชื่อธาตุที่อยู่หลัง โดยเปลี่ยนเสียงพยางค์ท้ายเป็น “ ไอด์” (ide)
- ให้ระบุจำนวนอะตอมของแต่ละธาตุด้วยเลขจำนวนในภาษากรีก ดังตาราง
- ถ้าสารประกอบนั้นอะตอมของธาตุแรกมีเพียงอะตอมเดียว ไม่ต้องระบุจำนวนอะตอมของธาตุนั้น แต่ถ้าเป็นอะตอมของธาตุหลังให้อ่าน “ มอนอ” เสมอ
การพิจารณารูปร่างโมเลกุลโควาเลนต์
โมเลกุลโควาเลนต์ในสามมิตินั้น สามารถพิจารณาได้จากการผลักกันของอิเล็กตรอนที่มีอยู่รอบๆ อะตอมกลางเป็นสำคัญ โดยอาศัยหลักการที่ว่า อิเล็กตรอนเป็นประจุลบเหมือนๆ กัน ย่อมพยายามที่แยกตัวออกจากกนให้มากที่สุดเท่าที่จะกระทำได้ ดังนั้นการพิจารณาหาจำนวนกลุ่มของอิเล็กตรอนที่อยู่รอบๆ นิวเคลียสและอะตอมกลาง จะสามารถบ่งบอกถึงโครงสร้างของโมเลกุลนั้น ๆ ได้ โดยที่กลุ่มต่างๆ มีดังนี้
- อิเล็กตรอนคู่โดดเดี่ยว
- อิเล็กตรอนคู่รวมพันธะได้แก่ พันธะเดี่ยว พันธะคู่ และพันธะสาม
- อิเล็กตรอนคู่รวมพันธะได้แก่ พันธะเดี่ยว พันธะคู่ และพันธะสาม
ทั้งนี้โดยเรียงตามลำดับความสารารถในการผลักอิเลคตรอนกลุ่มอื่นเนื่องจากอิเลคตรอนโดดเดี่ยวและอิเลคตรอนที่สร้างพันธะนั้นต่างกันตรงที่อิเล็กตรอนโดยเดี่ยวนั้นถูกยึดด้วยอะตอมเพียงตัวเดียว ในขณะที่อิเล็กตรอนที่ใช้สร้างพันธะถูกยึดด้วยอะตอม 2 ตัวจึงเป็นผลให้อิเลคตรอนโดดเดี่ยวมีอิสระมากกว่าสามารถครองพื้นที่ในสามมิตได้มากกว่า ส่วนอิเล็กตรอนเดี่ยวและอิเล็กตรอนคู่โดดเดี่ยว รวมไปถึงอิเล็กตรอนคู่ร่วมพันธะแบบต่าง ๆ นั้นมีจำนวนอิเลคตรอนไม่เท่ากันจึงส่งผลในการผลักอิเลคตรอนกลุ่มอื่นๆ ได้มีเท่ากัน โครงสร้างที่เกิดจกการผลักกันของอิเล็กตรอนนั้น สามารถจัดเป็นกลุ่มได้ตามจำนวนของอิเล็กรอนที่มีอยู่ได้ตั้งแต่ 1 กลุ่ม 2 กลุ่ม 3 กลุ่ม ไปเรื่อยๆ เรียกวิธีการจัดตัวแบบนี้ว่า ทฤษฎีการผลักกันของคู่อิเล็กตรอนวงนอก (Valence Shell Electron Pair Repulsion : VSEPR) ดังภาพ
ภาพแสดงรูปร่างโครงสร้างโมเลกุลโควาเลนต์แบบต่างๆ ตามทฤษฎี VSEPR
หมายเหตุ A คือ จำนวนอะตอมกลาง (สีแดง)
X คือ จำนวน อิเล็กตรอนคู่รวมพันธะ (สีน้ำเงิน)
E คือ จำนวนอิเล็กตรอนคู่โดดเดี่ยว (สีเขียว)
X คือ จำนวน อิเล็กตรอนคู่รวมพันธะ (สีน้ำเงิน)
E คือ จำนวนอิเล็กตรอนคู่โดดเดี่ยว (สีเขียว)
แรงยึดเหนี่ยวระหว่างโมเลกุล ( Van de waals interaction)
เนื่องจากโมเลกุลโควาเลนต์ปกติจะไม่ต่อเชื่อมกันแบบเป็นร่างแหอย่างพันธะโลหะหรือไอออนิก แต่จะมีขอบเขตที่แน่นอนจึงต้องพิจารณาแรงยึดเหนี่ยวระหว่างโมเลกุลด้วย ซึ่งจะเป็นส่วนที่ใช้อธิบายสมบัติทางกายภาพของโมเลกุลโควาเลนต์ อันได้แก่ ความหนาแน่น จุดเดือด จุดหลอมเหลว หรือความดันไอได้ โดยแรงยึดเหนี่ยวระหว่างโมเลกุลนั้นเกิดจากแรงดึงดูดเนื่องจากความแตกต่างของประจุเป็นสำคัญ ได้แก่
1. แรงลอนดอน ( London Force) เป็นแรงที่เกิดจากการดึงดูดทางไฟฟ้าของโมเลกุลที่ไม่มีขั้วซึ่งแรงดึงดูดทางไฟฟ้านั้นเกิดได้จากการเลื่อนที่ของอิเล็กตรอนอย่างเสียสมดุลทำให้เกิดขั้วเล็กน้อย และขั้วไฟฟ้าเกิดขึ้นชั่วคราวนี้เอง จะเหนี่ยวนำกับโมเลกุลข้างเคียงให้มีแรงยึดเหนี่ยวเกิดขึ้น ดังภาพ
อิเล็กตรอนสม่ำเสมอ........................อิเล็กตรอนมีการเปลี่ยนแปลงตามเวลา
ดังนั้นยิ่งโมเลกุลมีขนาดใหญ่ก็จุยิ่งมีโอกาสที่อิเลคตรอนเคลื่อนที่ได้เสียสมดุลมากจึงอาจกล่าวได้ว่าแรงลอนดอนแปรผันตรงกับขนาดของโมเลกุล เช่น F2 Cl2 Br2 I2 และ CO2 เป็นต้น
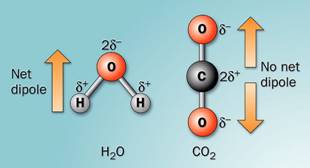
2. แรงดึงดูดระหว่างขั้ว (Dipole-Dipole interaction)เป็นแรงยึดเหนี่ยวที่เกิดระหว่างโมเลกุลที่มีขั้วสองโมเลกุลขึ้นไปเป็นแรงดึงดูดทางไฟฟ้าที่แข็งแรงกว่าแรงลอนดอน เพราะเป็นขั้นไฟฟ้าที่เกิดขึ้นอย่างถาวร โมเลกุลจะเอาด้านที่มีประจุตรงข้ามกันหันเข้าหากัน ตามแรงดึงดูดทางประจุ เช่น H2O HCl H2S และ CO เป็นต้น ดังภาพ
3. พันธะไฮโดรเจน ( hydrogen bond ) เป็นแรงยึดเหนี่ยวที่มีค่าสูงมาก โดยเกิดระหว่างไฮโดรเจนกับธาตุที่มีอิเล็กตรอนคู่โดดเดี่ยวเหลือ เกิดขึ้นได้ต้องมีปัจจัยต่างๆ ได้แก่ ไฮโดรเจนที่ขาดอิเล็กตรอนอันเนื่องจากถูกส่วนที่มีค่าอิเล็กโตรเนกาติวิตีสูงในโมเลกุลดึงไป จนกระทั้งไฮโดรเจนมีสภาพเป็นบวกสูงและจะต้องมีธาตุที่มีอิเลคตรอนคู่โดดเดี่ยวเหลือและมีความหนาแน่นอิเลคตรอนสูงพอให้ไฮโดรเจนที่ขาดอิเลคตรอนนั้น เข้ามาสร้างแรงยึดเหนี่ยวด้วยได้เช่น H2O HF NH3 เป็นต้น ดังภาพ
สภาพขั้วของโมเลกุลน้ำและก๊าซคาร์บอนไดออกไซด์
การเกิดพันธะไฮโดรเจนของโมเลกุลน้ำ
สมัครสมาชิก:
ความคิดเห็น (Atom)
-
โดยปกติแล้ว Xiaomi จะมี MIUI ให้ใช้ 2 รุ่น คือ stable ซึ่งจะปล่อยออกมาให้ผู้ใช้ติดตั้งเป็นรายเดือน และแบบ beta ที่ปล่อยออกมาให้ผู...
-
3.4 พันธะโลหะ พันธะโลหะ ( Metallic bonding) เป็นพันธะภายในโลหะซึ่งเกี่ยวข้องกับ การเคลื่อนย้าย อิเล็กตรอน อิสระระหว่างแลตทิซของ...